Artiklen har været bragt i Dansk Kemi nr. 3, 2025 og kan læses uden illustrationer, strukturer eller ligninger herunder
(læs originalartiklen her)
Af Jens Ulstrup1, Xinxin Xiao2, Adam Heller3 og Ture Damhus4
1 Institut for Kemi, Danmarks Tekniske Universitet
2 Institut for Kemi og Biovidenskab, Aalborg Universitet
3 1801 Lavaca Street, Apt/11E, Austin, TX 78701, United States
4 2100 København Ø, Danmark (tidligere hos Novozymes til 2019)
Den amerikanske biolog Jared Diamond har fremført, at store opdagelser sjældent sker ”strategisk”, fordi der er behov for dem, men fordi “nogen” synes, det er sjovt, og opdagelsen så næsten følger ”af sig selv” (”serendipitivt”). Undtagelser har inkluderet atomvåben, månekapløbet, i nyere tid måske Power-to-X og genteknologi [1]. Den danske forsker Detlev Müllers opdagelse af enzymet glucoseoxidase (GOx) i 1925, siden af overmåde stor betydning i behandling af diabetes, som mere end en tiendedel af verdens befolkning lider under [2], er et eksempel på en stor serendipitiv opdagelse. Indtil for nylig var Detlev Müllers opdagelse overset og fejlagtigt tilskrevet andre. Her i 100-året for opdagelsen fortæller vi historien og kommer lidt ind på enzymets egenskaber og mulige anvendelser. Glucoseoxidase er klassificeret af IUBMB som en oxidoreductase EC 1.1.3.4 (se faktaboks 1).
Alexander Flemings udvinding af penicillin fra svampetypen Penicillium ruben (en type mug) var ”strategisk” under indflydelse af et stort behov for ikke-toksiske antibiotika efter Første Verdenskrig. Omtrent samtidigt med Fleming opdagede Detlev Müller i 1925, at filtrater (“safter”) fra den almindeligt forekommende svamp, Aspergillus niger, udviste bakteriedræbende (baktericide) egenskaber. Det baktericide stof viste sig imidlertid senere ikke at være et egentligt molekylært antibiotikum, men hydrogenperoxid produceret af GOx-katalyseret O2-oxidation af glucose:
glucose + O2 → gluconsyre + H2O2 (1)
Der foreligger nu, meget senere, tredimensionale GOx-strukturer, der viser, at GOx er en dimer (figur 1). GOx er specifikt katalysator for oxidation af b-D-glucose med et flavincenter (FAD) som aktivt site. GOx anvendes bredt i elektrokemiske og andre typer glucosesensorer til præcis og hurtig bestemmelse af glucose i blodsukker hos diabetespatienter. GOx anses som ”ideelt” biosensorenzym på grund af enzymets glucosespecificitet, høje stabilitet og enzymaktivitet [3]. Der findes andre glucoseoxiderende enzymer, men GOx’s specificitet har gjort enzymet til det primære enzymvalg i kommercielle glucosebiosensorer. Med diabetes som en af verdens hyppigst forekommende dårligdomme vil GOx fortsat indtage en vital stilling i diabetesbehandlingen.
Detlev Müller og glucoseoxidase 1925-1929
Indtil for ikke så længe siden tilskrev det videnskabelige samfund Otto Warburg, Walter Christian, Vincent Massey og Hugo Theorell opdagelse, isolering, og karakterisering af det ”gule flavoenzym”, nu kendt som glucoseoxidase GOx, i de tidlige 1930’ere. Ingen af disse store navne synes at have kendt til Detlev Müllers opdagelse af GOx næsten ti år tidligere. I et nyligt arbejde har to af os søgt at vise, at kreditering for GOx’s opdagelse, isolering og første karakterisering rettelig tilkommer Detlev Müller [4].
Under sine fysiologiske studier af gær publicerede 26-årige Detlev Müller i 1925 en note omhandlende sin opdagelse af det nye enzym GOx i et ikke så udbredt tidsskrift [5]. Han udfældede GOx fra filtrat (”udpresset saft”) fra skimmelsvampen Aspergillus niger ved tilsætning af 2:1 (v/v) ethanol:ether. Efter tørring og opbevaring over CaCl2 i ekssikkator konstaterede han, at enzympulveret bevarede sin enzymaktivitet i månedsvis. Han fulgte enzymaktiviteten efter opløsning af pulveret i vand, absorption på filtrerpapir og overførsel til en glasbeholder med kviksølvmanometer. Tilsætning af glucose ledsagedes af O2-forbrug og trykfald i manometeret. Samtidig faldt opløsningens pH fra 5,5-6,6 til omkring 4,0. I opfølgende studier, blandt andet af forholdet mellem forbrugt glucose og O2, publiceret i 1928 i et meget bredere læst tidsskrift, Biochemische Zeitschrift [6], konkluderede Detlev Müller, at den producerede syre var gluconsyre, og at den enzymkatalyserede proces måtte være som i ligning (1). Figur 2 viser Detlev Müller i sit laboratorium i 1931 [7].
I 1929 viste Detlev Müller i endnu et arbejde i Biochemische Zeitschrift [9], at enzymet var selektivt. Tilsætning af mannose, galactose, fructose, arabinose eller xylose i stedet for glucose gav langsommere eller intet O2-trykfald. Optimal pH for hurtigst O2-forbrugvar pH 5,5-6,5. O2-forbrugshastigheden voksede med stigende temperatur mellem 0°C og 30°C, for derefter at falde til nul ved 73°C. I samme arbejde beskrev Detlev Müller isolering af GOx-holdigt filtrat fra gærsvampen Penicillium glaucum.
Detlev Müller havde gennem flere år ”fingrene helt nede” i sine enzympræparater. Der kan ikke være tvivl om, at han har bemærket, at farven på hans pulvere og opløsninger var gul, men som botaniker har han måske ikke tillagt den gule farve tilstrækkelig betydning til at rapportere det. Som nævnt gik anerkendelsen af opdagelsen af det første “gule enzym” i stedet til Otto Warburg og Walter Christian [10-14]. Alle involverede mente, at det først rapporterede flavoenzym var “det gamle gule enzym” glucose-6-phosphat-dehydrogenase [14], som Hugo Theorell havde vist var et flavoenzym [12,13].
Detlev Müller fortsatte sit arbejde, blandt andet med opdagelse af enzymerne mannitoldehydrogenase og alkoholdehydrogenase. Han blev medicinsk æresdoktor ved Københavns Universitet i 1991 kort før sin død i en alder af 94 år i 1993 [15].Kun få har været bekendt med, at det var Detlev Müller, der opdagede GOx som blot 26-årig og med ganske simpelt udstyr til rådighed.
Glucoseoxidases anvendelse i diabeteskontrol og andre glucoseassays
En “benchtop” elektrokemisk glucoseanalysator blev første gang beskrevet i 1950’erne af L.C. Clark [16], som placerede GOx mellem en membran og en platinelektrode, der registrerer koncentrationen af dioxygen, og fandt, at glucosekoncentrationen er korreleret med forbrug af dioxygen, jf. ligning (1). Clark fulgte op med et benchtop-system, der registrerede koncentrationen af det producerede hydrogenperoxid. Dette instrument, markedsført af Yellow Spring Instruments, blev standardmetode i klinisk glucosekemi. Alle hospitaler, kliniske laboratorier og mange lægeklinikker i dag er udstyret med benchtop-glucoseanalysatorer baseret på venøst blod udtaget med nål og sprøjte.
Ambulante GOx-systemer indført i 1960’erne er nu den bredeste GOx-anvendelse, brugt af hundreder af millioner diabetespatienter verden over. De første systemer var ikke bærbare, men fysisk små nok til hjemmebrug. Glucosekoncentrationen i en bloddråbe bestemtes fotometrisk ved at følge oxidationen af et leucofarvestof med det frigjorte hydrogenperoxid, jf. ligning (1) [14,18].
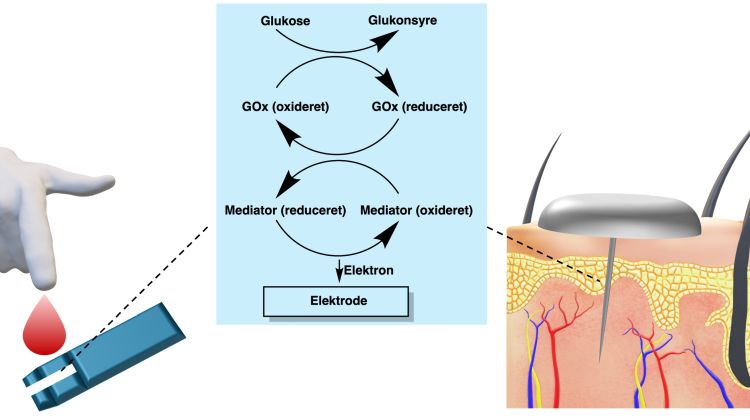
Fra 1980’erne blev de farvebaserede assays erstattet af amperometriske assays, baseret på måling af elektrokemisk genereret strøm [14]. Fotometeret (vægt ca. 1 kg) kunne nu undværes, blodprøverne reduceres til mellem 3 og 10 μL, og systemet blev bekvemt bærbart i patienternes lommer. GOx’s FADH2-reduktion af glucose ændredes fra to-elektronreduktion af O2 til to konsekutive én-elektronoverførsler mellem enzymet og elektroden via såkaldte mediatorer, for eksempel derivater af ferrocen [bis(h5-cyclopentadienyl)jern] [17]. I 2000 var blodprøverne nede på 300 nL eller en ottendedel af en mygs blodindtag ved et myggestik. I et nyt assay ændredes amperometri, hvor glucose opbruges og strømmen ændres under målingen, til måling af elektrisk ladning proportional med totalmængden af glucose.
Et slags plaster til hudpåsætning med en subkutant implanteret elektrokemisk enhed til kontinuert glucoseovervågning (CGM) (figur 3) blev indført i 2003. De første CGM-systemer var amperometriske, baseret på ligning (1), og krævede periodisk blodassay-kalibrering. FreeStyle Libre Flash fra Abbott Diabetes Care fra 2014 var det første blodfri fabrikskalibrerede system. Nutidige CGM-systemer bevarer deres kalibrering i to uger efter implantering. Hudplasterets miniaturesensor transmitterer den subkutane glucosekoncentration til patientens smartphone. FreeStyle Libre er verdens mest udbredte CGM-system, i 2024 anvendt af syv millioner diabetikere i 60 lande med en årlig stigning på mere end én million, i brugerantal det mest betydningsfulde medicinske hjælpemiddel nogensinde. I systemet indgår nye kemiske begreber [18], især GOx-FADH2-centrenes elektroniske kontakt (”wiring”) til elektroden gennem en elektrisk ledende osmium(2+/3+)-baseret hydrogel. Adskillelse af GOx fra den elektrisk ledende osmium-polymer forebygges ved elektrostatisk stabilisering, idet GOx er en polyanion ved fysiologisk pH og hydrogelens krydslinkede polymer er polykationisk.
De subkutane kontinuert glucoseovervågende sensorers brugervenlighed og prisvenlighed er under udbredelse, også til raske ikke-diabetiske mennesker, der kan have ønske om at kontrollere deres blodsukkerniveau (glykæmi) for at følge deres fysiske aktivitet, diæt, eller blot fordi de interesserer sig for helbredseffekter ved deres kost. Mobiltelefon-forbundne hudplastre som Lingo og Abbott Diabetes Care markedsføres nu receptfrit i USA.
Glucoseoxidase i videnskab og undervisning
GOx indtager en høj status i videnskabelig forskning og undervisning, ikke mindst afspejlet i antallet af videnskabelige publikationer omhandlende enzymet. Ifølge Scifinder Scholars database er der 16. februar 2025 registreret 9545 publikationer, patenter og andre dokumenter med “glucose oxidase” i titlen og ikke færre end 2 829 537 millioner dokumenter med nøgleordet ”glucose oxidase”. Samme dato viser Google Scholar-databasen 7040 artikler foruden patenter med ”glucose oxidase” i titlen, og omkring 605000 artikler, der medtager citationer med disse søgeord.
Til trods for GOx’s eksklusive status i ren og anvendt bioelektrokemi frembyder enzymet dog stadig udfordringer. Mediatorfri direkte elektronoverførsel (DET) mellem enzymets katalytiske center og elektroden ville være et stort skridt videre mod et ”ideelt” enzym, men GOx’s flavincentre, som skal forbindes direkte med elektrodeoverfladen, ligger alt for dybt inde i en proteinskal, til at elektroner kan tunnellere igennem skallen. Der er rapporter om GOx-DET, men de skyldes formentlig mistolkede signaler fra frie FAD-grupper i utilstrækkeligt oprenset GOx. Det kan imidlertid ikke udelukkes, at bioteknologiens hurtige fremskridt, måske med brug af nye værktøjer som AI i proteindesign og -foldning, kan give håb om, at enzyme engineering snart kan frembringe et superideelt glucoseoxiderende enzym eller eventuelt et mindre, men effektivt, GOx-lignende katalysatormolekyle.
Andre anvendelser af glucoseoxidase
Da glucoseoxidase katalyserer dannelse af hydrogenperoxid fra glucose og dioxygen, er det naturligt at spørge, om enzymet kan nyttiggøres i processer, hvor der er luftadgang og behov for hydrogenperoxid. Siden forrige århundredeskifte har man tilsat forbindelser til tøjvaskemidler, som frigiver hydrogenperoxid under vaskeprocessen (natriumperborat og natriumpercarbonat [19-21]). På det tyske marked kom Persil, indeholdende perborat og silicat. Ved højt pH og høj temperatur virker hydrogenperoxid og (måske især) dets korresponderende base blegende på en række af de farvede besmudsninger, der forekommer på vasketøj (for eksempel frugt- og bærfarver, rødvin, karry, kaffe og te). Kunne man spare tilsætningen af hydrogenperoxidkilden ved i stedet at tilsætte en oxidase og et substrat og udnytte luftens dioxygen til dannelse af hydrogenperoxid? Et grønt alternativ?
Der viste sig at være vanskeligheder: Som sagt var højt pH nødvendigt for tilfredsstillende peroxidblegning, men glucoseoxidases pH-optimum lå for lavt. Glucose var desuden ikke et vægteffektivt substrat; for at opnå de nødvendige cirka 10 mM hydrogenperoxid i vaskevæsken måtte bruges op mod 2 g glucose/L vaskevæske (10 mmol glucose = 1802 mg). De nævnte persalte var omtrent dobbelt så vægteffektive og meget billigere end et dyrt enzym, fremstillet ved en sofistikeret proces, hvor det også skulle undgås, at produktionsorganismen samtidig producerede catalase (hvilket den typisk ville gøre for at beskytte sig selv). Det korte af en lang historie med mange industrielle forsøg på at få glucoseoxidase og andre oxidaser til at fungere i vaskeprocesser er, at det ikke er lykkedes i kommerciel skala. Detaljerne er diskuteret i [22]. Om anvendelse af andre oxidative enzymer til tekstilblegning, se [20].
Glucoseoxidasesystemet har til gengæld fundet en vis anvendelse i vin- og fødevareindustrierne, hvor reaktionsbetingelserne er gunstigere. Et eksempel er forstærkning af gluten (ved oxidation med dannet hydrogenperoxid) i bageriindustrien [21,23], hvorved anvendelse af traditionelle kemikalier som bromat kan undgås. En fordel her har været, at substratet var naturligt til stede i dejmatricen. Andre områder er produktion af vin og saft, ost, og fødevarer til diabetikere. Interessant er det, at alle aspekter af den katalyserede reaktion finder anvendelse: fjernelse af dioxygen (uønsket ved oxidationsfølsomme fødevarer – her er det vigtigt også at fjerne den dannede hydrogenperoxid, typisk med catalase); eller netop udnyttelse af dannet hydrogenperoxids antimikrobielle effekt; fjernelse af glucose; og endelig udnyttelse af dannet gluconsyre (som har flere mulige funktioner, for eksempel surhedsregulering og kompleksdannelse). Se videre i [23].
Én meget speciel, men særdeles raffineret proces, kan nævnes. Tandpasta af mærket Zendium indeholder et komplekst antimikrobielt system bestående af enzymerne amyloglycosidase, glucoseoxidase og lactoperoxidase, der virker sammen med substraterne amylose og thiocyanat. Amylose kan være tilsat tandpastaen eller hidrøre fra stivelsesrester i tænderne og spaltes af amyloglycosidase til glucose. Glucoseoxidase sørger så for dannelse af hydrogenperoxid, som under katalyse fra lactoperoxidase oxiderer thiocyanat (SCN–) til det aktive antimikrobielle hypothiocyanit (OSCN–), alt i alt en forstærkning af det naturligt forekommende antibakterielle system i spyttet.
Oplysning om interesser: AH er Ernest Cockrell Sr. Chair Emeritus of Engineering, University of Texas at Austin. Sammen med sin søn Ephraim grundlagde han i 1996 virksomheden TheraSense, der blev overtaget af Abbott Laboratories 2004 og nu udgør hovedparten af Abbott Diabetes Care. Han er i dag konsulent for Abbott Diabetes Care.
Referencer
1. Diamond, J. Guns, Germs and Steel 1997 [Vintage Publ., London].
2. Sun, H.; Saeedi, P.; Karuranga, S.; Pinkepank, M.; Ogurtsova, K.; Duncan, B.B.; Stein, C.; Basit, A.; Chan, J.C.N.; Mbanya, J.C.; et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022, 183, 109119.
3. Wilson, R.; Turner A.P.F. Glucose oxidase: an ideal enzyme. Biosensors and Bioelectronics, 1992, 7, 165-185.
4. Heller, A; Ulstrup, J. Detlev Müller’s Discovery of Glucose Oxidase in 1925. Anal. Chem. 2021, 93, 7148-7149.
5. Müller, D. A new enzyme, glucoseoxidase, from Aspergillus niger. Den Kgl. Veterinær- og Landbohøjskoles Aarsskrift (Copenhagen) 1925, 329-31.
6. Müller, D. Studies on the new enzyme glucoseoxidase. I. Biochem. Z. 1928, 199, 136-70.
7. Københavns Universitet 1479–1979, vol. XIII (2), side 509-510 [Gad 1983]. Fotografiet stillet til rådighed af videnskabshistoriker Morten Fink-Jensen og naturvidenskabelig bibliotekar Christian Knudsen, begge Københavns Universitet. Fotografiet publiceret i 1979 ved universitetets 500-års jubilæum.
8. Detlev Müller. i: Den Store Danske Encyklopædi. Downloadet 25. februar 2025 fra: https://denstoredanske.lex.dk/Detlev_Müller. Fotograf: Christian Brandt.
9. Müller, D. A new enzyme, glucoxidase. II. Biochem. Z. 1929, 205, 111-43.
10. Warburg, O.; Christian, W. The yellow oxidizing enzyme. Biochem. Z. 1933, 258, 496-498.
11. Stott, K.; Saito, K.; Thiele, D.J.; Massey, V. Old Yellow Enzyme. The discovery of multiple isozymes and a family of related proteins. J. Biol. Chem. 1993, 268 (9), 6097-6106.
12. Theorell, H., Purification of the yellow respiratory enzyme and its reversible decomposition. Biochem. Z. 1934, 272, 155-156.
13. Theorell, H. Quantitative irradiation experiments with the yellow enzyme, flavin phosphate and lactoflavin. Biochem. Z. 1935, 279, 186-200.
14. Heller, A.; Feldman, B., Electrochemical Glucose Sensors and Their Applications in Diabetes Management. Chem. Rev. 2008, 108, 2482-2505.
15. Schjørring, J.K. Detlev Müller i: Den Store Danske Encyklopædi lex.dk. Downloadet 25. februar 2025 fra https://denstoredanske.lex.dk/Detlev_Müller.
16. Clark, L.C. Monitor and Control of Blood and Tissue Oxygen Tensions. Trans. Am. Soc. Artif. Intern. Organs, 1956, 2, 41-48.
17. Cass, A.E.G.; Davis, G.; Francis, G.D.; Hill, H.A.O.; Aston, W.J.; Higgins, I.J.; Plotkin, E.V.; Scott, L.D.L.; Turner, A.P.F. Ferrocene-mediated enzyme electrode for amperometric determination of glucose, Anal. Chem. 1984, 56, 667-671.
18. Heller, A.; Feldman, B. Electrochemistry in Diabetes Management. Acc. Chem. Res. 2010, 43 (7), 963-973.
19. Damhus, T. Blegesystemer i vaskemidler, Dansk Kemi 2005, 86 (10) 9-12.
20. Damhus, T. Fra vaskefiasko til tekstilsucces – en overraskende udvikling med en industriel oxidoreductase, Kemi og klæ’r – Tekstilkemi i historisk perspektiv 2011, nr. 20 i serien Historisk-kemiske skrifter (Dansk Selskab for Historisk Kemi), side 167-176.
21. Lobedanz, S.; Damhus, T.; Borchert, T.V.; Hansen, T.T.; Lund, H.; Lai, W.; Lin, M.; Leclerc, M.; Kirk, O. Enzymes in Industrial Biotechnology. In Kirk-Othmer Encyclopedia of Chemical Technology 2016 [John Wiley & Sons, Inc]. https://doi.org/10.1002/0471238961.0914042114090512.a01.pub3].
22. Gormsen, E.; Marcussen, E.; Damhus, T. Enzymes, i M.S. Showell (Ed.): Powdered Detergents, Surfactant Science Series 1997, 71 [Marcel Dekker], pp. 137-163.
23. Bauer, J.A.; Zámocká, M.; Majtán, J.; Vladena Bauerová-Hlinková, V. Glucose Oxidase, an Enzyme “Ferrari”: Its Structure, Function, Production and Properties in the Light of Various Industrial and Biotechnological Applications. Biomolecules 2022, 12 (3), 472-496. doi: 10.3390/biom12030472.
24. International Union of Biochemistry and Molecular Biology: ExplorEnz – the Enzyme Database, https://www.enzyme-database.org.
E-mail:
Jens Ulstrup: ju@kemi.dtu.dk
BOKS 1:
Enzymnomenklatur
Enzymer kan identificeres på flere måder, for eksempel kan deres struktur som proteiner beskrives, eller deres genetiske ophav i en organisme, der producerer dem, kan specificeres. En anden tankegang ligger til grund for enzymnomenklatur, som ikke er en navngivning af molekylære strukturer som for eksempel i systematisk organisk-kemisk nomenklatur, men hvor den katalyserede reaktion opfattes som definerende for enzymet. Siden 1961 er enzymer klassificeret i IUBMB’s database [24], ordnet med EC-numre (EC = Enzyme Committee) og for hvert enzym, ud over angivelse af reaktionen, forskellige navne (som ikke nødvendigvis anbefales) og nogle kildehenvisninger til litteratur og andre databaser. Posten EC 1.1.3.4 er et eksempel. Der er ikke en målsætning om en fuldstændig dokumentation af opdagelseshistorien eller enzymologien; specielt bemærkes, at Detlev Müller ikke figurerer i litteraturlisten. EC-numrene er en nyttig klassifikation i praksis, for eksempel i industriel patentering, da man grupperer forskellige proteiner, der katalyserer samme reaktion, uden at behøve at specificere alle proteinkemiske detaljer.
| EC | 1.1.3.4 |
| Accepted name: | glucose oxidase |
| Reaction: | β-D-glucose + O2 = D-glucono-1,5-lactone + H2O2 |
| Other name(s): | glucose oxyhydrase; corylophyline; penatin; glucose aerodehydrogenase; microcid; β-D-glucose oxidase; D-glucose oxidase; D-glucose-1-oxidase; β-D-glucose:quinone oxidoreductase; glucose oxyhydrase; deoxin-1; GOD |
| Systematic name: | β-D-glucose:oxygen 1-oxidoreductase |
| Comments: | A flavoprotein (FAD). |
| References: | 1. Bentley, R. Glucose oxidase. In: Boyer, P.D., Lardy, H. and Myrbäck, K. (Eds.), The Enzymes, 2nd edn, vol. 7, Academic Press, New York, 1963, pp. 567-586. 2. Coulthard, C.E., Michaelis, R., Short, W.F., Sykes, G., Skrimshire, G.E.H., Standfast, A.F.B., Birkinshaw, J.H. and Raistick, H. Notatin: an anti-bacterial glucose-aerodehydrogenase from Penicillium notatum Westling and Penicillium resticulosum sp. nov. Biochem. J. 39 (1945) 24-36. [PMID: 16747849] 3. Keilin, D. and Hartree, E.F. Properties of glucose oxidase (notatin). Biochem. J. 42 (1948) 221-229. [PMID: 16748271] 4. Keilin, D. and Hartree, E.F. Specificity of glucose oxidase (notatin). Biochem. J. 50 (1952) 331-341. [PMID: 14915954] |
[EC 1.1.3.4 created 1961]
BOKS 2:
En biosensor består af en biologisk føler (sensor), der reagerer på et biologisk materiale og omsætter reaktionen til for eksempel et elektrisk signal. Selve den biologiske del af sensoren kan være enzymer, DNA, antistoffer eller hele mikroorganismer. De bedst kendte biosensorer er til elektrokemisk måling af glucose i blodet hos diabetikere. Den biologiske føler er her enzymet glucoseoxidase adsorberet på en elektrodeoverflade, hvor en redoxproces mellem enzym og glucose konverteres til elektrisk strøm, jf. figur 1 og 3.
BOKS 3:
Detlev Müller (født 1899)blev mag.scient. i botanik og plantefysiologi 1923og dr.phil. 1928 (disputats: Et nyt Enzym – Glykose-oxydase – fra Skimmelsvampe). Tidligt foretog han studierejser, til Bonn 1920 og Paris 1926, senere til mere eksotiske steder: Grønland 1927 og Cote d’Ivoires (Elfenbenskystens) tropiske regnskove (planters fotosyntese og respiration) i 1954, 1955 og 1957. Han var assistent ved Den Kgl. Veterinær- og Landbohøjskole (KVL) 1923-26 og KVL’s Plantefysiologiske Institut 1927-35, siden professor i plantefysiologi ved KVL 1935-1949 og Københavns Universitet 1949-1969. Han arbejdede desuden i sit lange virke i faglige bestyrelser, som lærebogsforfatter, redaktør af større videnskabelige værker m.m.

